Orbitali molecolari, non le orbite dei pianeti che troviamo nel sistema solare. Passiamo da dimensioni gigantesche a dimensioni microscopiche e ritroviamo delle analogie che affascinano. Ora andiamo a scoprire cosa succede negli atomi, come si “sistemano” gli elettroni attorno ai nuclei di una molecola. Gli orbitali molecolari sono stati pensati per cercare di rappresentare al meglio i misteri della natura riguardanti atomi, molecole e reazioni chimiche. Vengono spesso impiegati in fisica, in particolare nella fisica dello stato solido, materia in cui un orbitale molecolare rappresenta la distribuzione spaziale degli elettroni in una molecola.
Orbitali molecolari: cosa sono
Questo concetto è stato introdotto per la prima volta da due scienziati, Friedrich Hund e Robert S. Mulliken, siamo tra il 1927 e il 1928, che hanno rappresentato gli orbitali molecolari come funzioni d’onda il cui quadrato descrive la distribuzione di probabilità relativa alla posizione dell’elettrone.
Per ottenere queste funzioni d’onda, è necessario partire dall’equazione d’onda che descrive l’intera molecola e nella maggior parte dei casi si utilizzano delle approssimazioni per ottenere una soluzione. L’approssimazione più frequente consiste nello scrivere l’orbitale molecolare come combinazione lineare degli orbitali atomici dei singoli atomi. E’ questa è la teoria degli orbitali molecolari.
Orbitali molecolari: teoria
La teoria serve per descrivere una sorta di tecnica che arriva a determinare la struttura molecolare con una approssimazione utile per comprendere cosa accade tra molecole. Pur consapevoli che si tratti di una approssimazione, se funziona, la si usa per procedere con lo studio. Nel caso della teoria degli orbitali molecolari, si suppone che gli elettroni non siano assegnati a particolari legami chimici, quindi li si tratta come oggetti che si muovono sotto l’influenza dei nuclei all’interno dell’intera molecola.
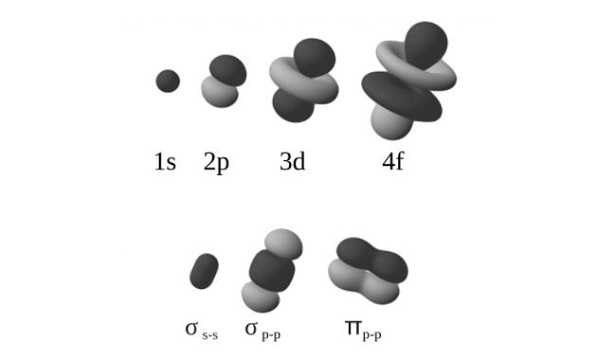
Orbitali molecolari: chimica
In chimica si utilizza molto questa teoria, si va a calcolare anche l’ordine di legame che è un indice della forza del legame stesso e serve anche per applicare la teoria del legame di valenza.
Immaginiamo un orbitale molecolare come un grande orbitale che coinvolge due o più atomi uniti da un legame covalente, è come se avvenisse una fusione per sovrapposizione di due orbitali atomici. A seconda della direzione su cui avviene questa sovrapposizione, gli orbitali prendono nomi diversi. Se ci si trova sulla congiungente i due nuclei, l’orbitale molecolare prende il nome di σ (sigma); se siamo posti perpendicolarmente all’asse che unisce i due nuclei, l‘orbitale molecolare prende il nome di π (pi greco).

Orbitali molecolari: caratteristiche
Pur agendo per approssimazione, ci si pone delle regole e delle linee in modo che approssimazione non coincida con confusione, cosa che invaliderebbe la teoria. Ci sono delle caratteristiche che gli orbitali molecolari devono avere. Ad esempio il loro numero deve essere pari al numero di orbitali atomici contenuti nella combinazione lineare dalla quale sono costituiti.
Il numero di orbitali molecolari appartenenti alla rappresentazione di un gruppo è pari al numero di orbitali atomici appartenenti a tale rappresentazione. Se poi la molecola possiede simmetrie, gli orbitali atomici caratterizzati dalla stessa energia, vengono raggruppati in combinazioni lineari che appartengono alla rappresentazione del gruppo di simmetria.
Per quanto riguarda le modalità con cui gli orbitali atomici si mischiano tra loro all’interno di una particolare rappresentazione, essi lo fanno maggiormente se hanno livelli di energia atomici vicini.
Orbitali molecolari: rappresentazione
Oltre alle due tipologie di orbitali molecolari che abbiamo già citato, quello indicato con la lettera greca sigma e quello indicato con la lettera greca pi, ce ne è un terzo che porta la lettera delta come segno di riconoscimento.
Questa è la tipologia di orbitale che si ottiene dalla sovrapposizione di quattro lobi di due orbitali atomici. Esistono in questo caso due piani nodali siti fra i due nuclei che contraggono tale legame. Il delta si trova ad esempio in caso di legame quadruplo, un legame importante nella chimica inorganica e che caratterizza particolari tipi di cluster.
Se vi è piaciuto questo articolo continuate a seguirmi anche su Twitter, Facebook, Google+, Instagram
Articoli correlati che possono interessarvi:
