“Tempo di vita dei gas serra” è il nuovo articolo frutto della collaborazione tra l’Area Valorizzazione e Impatto della Ricerca e Public Engagement – Agorà Scienza – e dal Green Office UniToGO dell’Università di Torino con la IdeeGreen S.r.l. Società Benefit.
L’articolo riprende i testi del prof. Minella e del dott. Tommaso Orusa pubblicati nell’opera “Lessico e Nuvole: le parole del cambiamento climatico”, la seconda edizione della guida linguistica e scientifica per orientarsi nelle più urgenti questioni relative al riscaldamento globale, curata dall’Area e dal Green Office.
La versione gratuita di Lessico e Nuvole, sotto forma di file in formato .pdf, è scaricabile dalla piattaforma zenodo.org.
La versione cartacea e l’eBook sono acquistabili online sulle seguenti piattaforme di distribuzione:
– Amazon
– Mondadori (anche con Carta del Docente e 18app)
– IBS
– Libreria Universitaria (anche con Carta del Docente e 18app)
Tutto il ricavato delle versioni a pagamento sarà utilizzato dall’Università di Torino per finanziare progetti di ricerca e di public engagement sui temi dei cambiamenti climatici e della sostenibilità.
Cosa sono i tempi di vita dei gas serra
Per descrivere la permanenza di una sostanza (o anche di un isotopo radioattivo) nell’atmosfera, di solito si utilizza un parametro detto “tempo di latenza”, meglio noto come “tempo di vita medio” (mean lifetime) o, a volte, il “tempo di semivita/emivita”, che rappresentano rispettivamente il tempo dopo il quale è ancora presente in atmosfera (o in un dato ambiente) il 37% e il 50% della quantità iniziale.
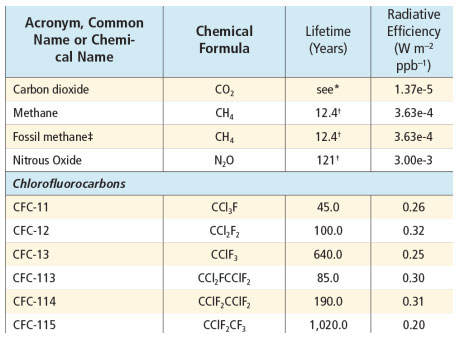
Generalmente le sostanze hanno uno specifico processo di rimozione, e la cinetica di decadimento è di tipo esponenziale (o del primo ordine), per cui il tempo di vita medio e il tempo di semivita possono essere stimati a partire dalla costante che descrive il decadimento esponenziale (tempo di vita medio e di semivita sono rispettivamente l’inverso della costante di decadimento e l’inverso moltiplicato per il logaritmo di 2). Per molte sostanze inquinanti o climalteranti (gas serra) esistono delle apposite raccolte, generate a partire da studi di chimica e fisica, dei tempi di vita dei principali composti presenti in atmosfera, ad esempio la tabella 8.A.1 del quinto rapporto IPCC (“AR5”), volume 1.
Come si può osservare nella tabella sotto riportata, per il diossido di carbonio (CO2) non è indicato un valore di tempo di vita medio, ma c’è una nota alla seguente dicitura: “No single lifetime can be given”. C’è quindi il rimando a un rilevante articolo di Joos et al. del 2013 che ha confrontato l’andamento stimato da diversi modelli del CO2 in atmosfera dopo un’emissione impulsiva.
Formula per calcolare la presenza di CO2
Una formula semplificata proposta per calcolare la presenza del CO2 dopo “t” anni dalla sua immissione è: CO2 (%) = 21,7 + 25,9e−t/172,9 + 33,8e−t/18,51 + 18,6e−t/1,186 Quando emettiamo una certa quantità di CO2, metà del CO2 aggiunto è rimosso dall’atmosfera entro 30 anni, un terzo è presente nell’atmosfera dopo circa 100 anni e un quinto ancora dopo 1000 anni; e continua in tutto questo tempo a esercitare il suo potere riscaldante di gas serra.
Infatti, anche se il tempo di vita medio in atmosfera di una molecola di CO2 è di circa 3 anni, va considerato che una volta assorbita dall’oceano la stessa molecola può essere riemessa nell’atmosfera.
Di conseguenza il “tempo di residenza” di una parte consistente delle molecole di CO2 nell’intero sistema aria – oceano – biosfera, considerando anche lo scambio con i carbonati solidi della Terra, è molto più lungo, dell’ordine di circa 100.000 anni. Se si confronta l’andamento del decadimento del CO2 con quello degli altri due più importanti composti climalteranti (il metano CH4 e il protossido di azoto N2O), si intuisce che il problema è che, a differenza di CH4 e N2O che hanno tempi di vita medi di 12,4 e 121 anni, l’andamento del CO2 ha una “coda” molto lunga: un decimo del CO2 emesso rimane in atmosfera per molte decine di migliaia di anni. Su questa scala temporale, il CO2 continua a essere rimosso dall’oceano, perché la parte già assorbita dal mare reagisce e si dissolve in forma di bicarbonato e permette ad altre molecole di CO2 atmosferico di essere assorbite.
Quando il diossido di carbonio si dissolve in acqua reagisce chimicamente formando acido carbonico e quindi carbonati e bicarbonati, e questo permette a ingenti quantità di carbonio di essere presente nell’acqua del mare (il 98% del carbonio presente nel sistema atmosfera/oceano è nel mare, solo il 2% in atmosfera).
Se non ci fosse la reazione chimica di formazione dei bicarbonati (e quindi il sequestro in forma ionica), sulla base del valore della costante di Henry del CO2, la ripartizione di carbonio fra atmosfera e oceani sarebbe molto diversa. Nel lunghissimo periodo (> 15.000 anni) diventa preponderante il (lento) processo di rimozione di CO2 tramite la sua reazione con le rocce, ovvero i silicati solidi della Terra, per formare carbonati. Le implicazioni della comprensione di questa particolarità del CO2 sono molte.
La prima è che non è saggio continuare a emettere CO2 in atmosfera se si vuole fermare il riscaldamento globale.
La seconda è che le conseguenze delle (mancate) politiche attuali di contenimento delle emissioni di CO2 dureranno molte migliaia di anni.
La terza è che se si vuole ridurre la presenza di CO2 nell’atmosfera in tempi rapidi e in modo sensibile (es. tornare a 350 ppm) non basta mandare a zero le emissioni, ma bisogna trovare il modo di sottrarre il diossido di carbonio in eccesso (si veda l’articolo “Pozzi e fonti di carbonio”).
prof. Marco Minella, Dipartimento di Chimica – Università di Torino; Coordinamento Cambiamenti Climatici UniTo GreenOffice UniToGo
dott. Tommaso Orusa, Gruppo Energia e Coordinamento Cambiamenti Climatici UniTo Green Office UniToGO; Dipartimento di Scienze Agrarie, Forestali e Alimentari – Università di Torino
Bibliografia
– Latini Gianni, Bagliani Marco, & Orusa Tommaso. (2020). Lessico e nuvole: le parole del cambiamento climatico – II ed., Università di Torino. Zenodo. http://doi.org/10.5281/zenodo.4276945
– Archer, David, and Victor Brovkin. “The millennial atmospheric lifetime of anthropogenic CO2.” Climatic Change 90.3 (2008): 283-297.
– Berner, Robert Arbuckle, and Robert A. Berner. “The Phanerozoic carbon cycle: CO2 and O2”. Oxford University Press on Demand, 2004.
– Strassmann, Kuno M., and Fortunat Joos. “The Bern Simple
Climate Model (BernSCM) v1. 0: an extensible and fully documented open-source re-implementation of the Bern reducedform model for global carbon cycle–climate simulations.” Geoscientific model development (GMD) 11.5 (2018): 1887-1908.
– Clark, Peter U., et al. “Consequences of twenty-first-century policy for multi-millennial climate and sea-level change.” Nature climate change 6.4 (2016): 360-369.
– Joos, Fortunat, et al. “Carbon dioxide and climate impulse response functions for the computation of greenhouse gas metrics: a multi-model analysis.” Atmospheric Chemistry and Physics 13.5 (2013): 2793-2825.
– Levi Primo, “Carbonio”. In “Il sistema periodico”, Einaudi (Supercoralli Nuova serie) , 1975, Torino.
– Myhre, G., D. Shindell, F.-M. Bréon, W. Collins, J. Fuglestvedt, J. Huang, D. Koch, J.-F. Lamarque, D. Lee, B. Mendoza, T. Nakajima, A. Robock, G. Stephens, T. Takemura and H. Zhang, 2013: “Anthropogenic and Natural Radiative Forcing”. In: Climate Change 2013: The Physical Science Basis. Contribution of Working Group I to the Fifth Assessment Report of the Intergovernmental Panel on Climate Change [Stocker, T.F., D. Qin, G.-K. Plattner, M. Tignor, S.K. Allen, J. Boschung,A. Nauels, Y. Xia, V. Bex and P.M. Midgley (eds.)]. Cambridge University Press, Cambridge, United Kingdom and New York, NY, USA.
– Strassmann, Kuno M., and Fortunat Joos. “The Bern Simple Climate Model (BernSCM) v1. 0: an extensible and fully documented open-source re-implementation of the Bern reduced-form model for global carbon cycle–climate simulations.” Geoscientific model development (GMD) 11.5 (2018): 1887-1908.
